即可将网页分享至朋友圈
12月13日,医学院王晨辉教授团队联合四川省人民医院病理科肖雪副研究员、张存金教授和青年教师杜艳芸在T细胞代谢调控新机制及外周T细胞淋巴瘤精准治疗靶点方面取得新进展,研究成果以“MYO1F regulates T-cell activation and glycolytic metabolism by promoting the acetylation of GAPDH”为题,发表在Cellular & Molecular Immunology期刊上。
在感染和癌症过程中,幼稚T细胞遇到抗原会被激活并分化成效应T细胞,这个过程中T细胞会伴随着营养的吸收以及代谢的剧烈变化。当再次遇到相同抗原时,记忆性T细胞会迅速有效作出反应以便清除病原体,T细胞也伴随着强烈的代谢变化。适当的代谢程序变化可确保T细胞在不同的免疫反应中发挥适当的功能,从而增加T细胞对病原体的清除以及癌细胞的杀伤。然而,T细胞的代谢变化被认为与许多疾病的发生相关,例如癌症和自身免疫性疾病。靶向T细胞代谢在治疗许多疾病如癌症和自身免疫性疾病等方面具有广阔的治疗潜力。MYO1F-VAV1融合基因经常在人的外周T细胞淋巴瘤(PTCL)中被发现,而且人的MYO1F-VAV1融合基因在小鼠T细胞中过表达会诱导外周T细胞淋巴瘤样疾病。然而,MYO1F-VAV1融合蛋白影响PTCLs发生的机制尚不清楚。
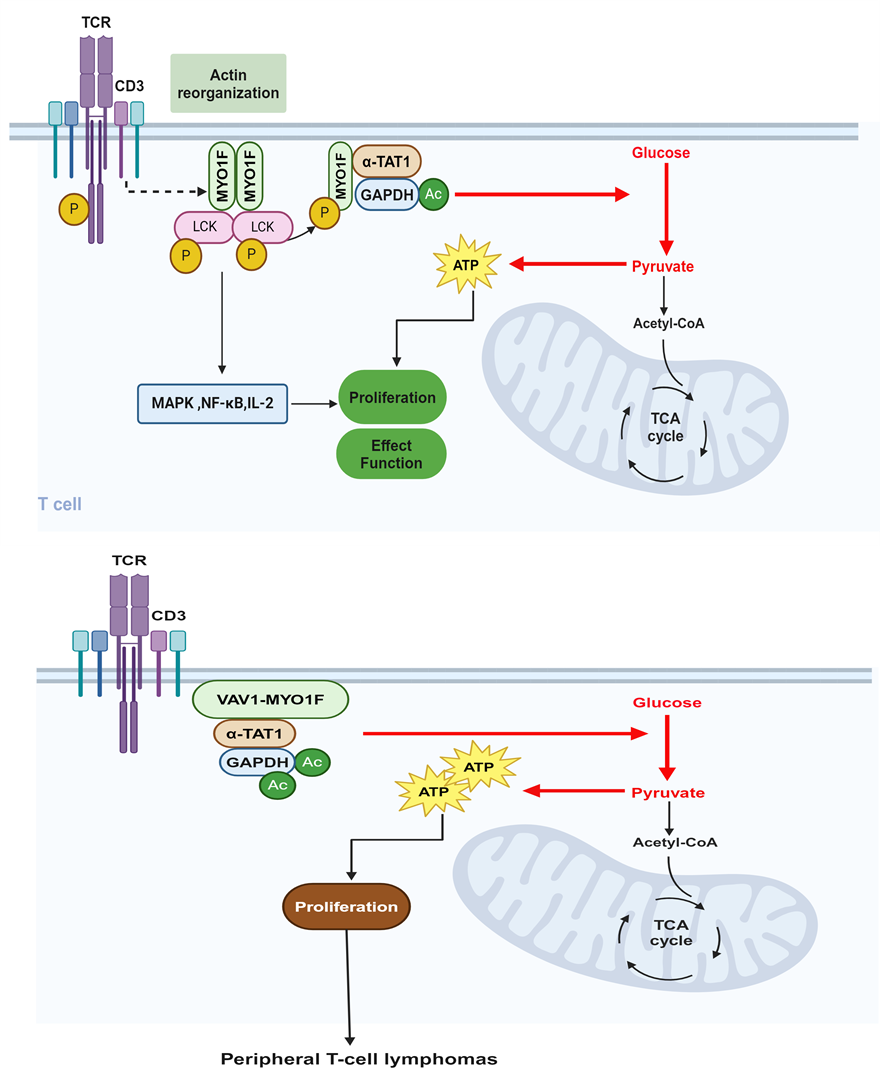
该团队研究发现,MYO1F在TCR刺激激活T细胞的过程中发挥了重要作用。首先,MYO1F是TCR刺激诱导人和鼠的T细胞活化和增殖所必需的,并且由于体内T细胞活化受损,T细胞特异性敲除Myo1f的小鼠表现出肿瘤负荷显著增加以及EAE严重程度显著减轻。具体机制方面,在TCR刺激后,MYO1F的酪氨酸607和634位点被LCK磷酸化,这对于MYO1F招募α-TAT1(一种乙酰基转移酶)至关重要。α-TAT1进而乙酰化GAPDH的第84、86和227位的赖氨酸,这一过程促进了T细胞的激活和糖酵解代谢,进而影响了T细胞的效应功能。这一发现不仅促进了我们对T细胞激活与代谢调控机制的理解,也为未来免疫细胞功能失调和肿瘤形成的研究提供了新的视角。
更重要的是,研究还发现MYO1F-VAV1融合蛋白是导致复发性外周T细胞淋巴瘤的驱动因子。机制研究发现,MYO1F-VAV1增强了与α-TAT1的结合,并招募更多的α-TAT1从而促进GAPDH的过高水平的乙酰化和异常激活,进而导致T细胞的异常增殖及代谢失调。研究团队还发现,通过抑制GAPDH的活性能够显著延长hVAV1-MYO1F基因敲入小鼠的生存期。另外,研究团队还进一步在携带有VAV1-MYO1F融合基因的PTCL患者样本中验证了GAPDH的高乙酰化水平,明确其与病理状态相关联。
综上所述,这项研究为T细胞的功能调控以及PTCL的精准治疗提供了新的线索和靶标,为疾病的精准治疗提供了研究范例。

王晨辉教授实验室博士生崔智慧、博士生王和平为论文共同第一作者。医学院王晨辉教授、四川省人民医院病理科肖雪副研究员、张存金教授及青年教师杜艳芸为文章的共同通讯作者。
Cellular & Molecular Immunology属于中国科学院医学免疫学双1区Top期刊。
原文链接:https://doi.org/10.1038/s41423-024-01247-6
编辑:刘瑶 / 审核:李果 / 发布:陈伟


