即可将网页分享至朋友圈
近日,电子科技大学医学院、电子科技大学附属医院•四川省人民医院肖波教授团队在口服药物系统治疗结肠疾病方面取得了新进展,研究成果以“Reinforced plant-derived lipid nanoparticles for oral precise epigenome editing in colonic diseases”为题,发表于《Science Advances》(Science子刊)期刊上。肖波教授的博士生高强为论文第一作者。

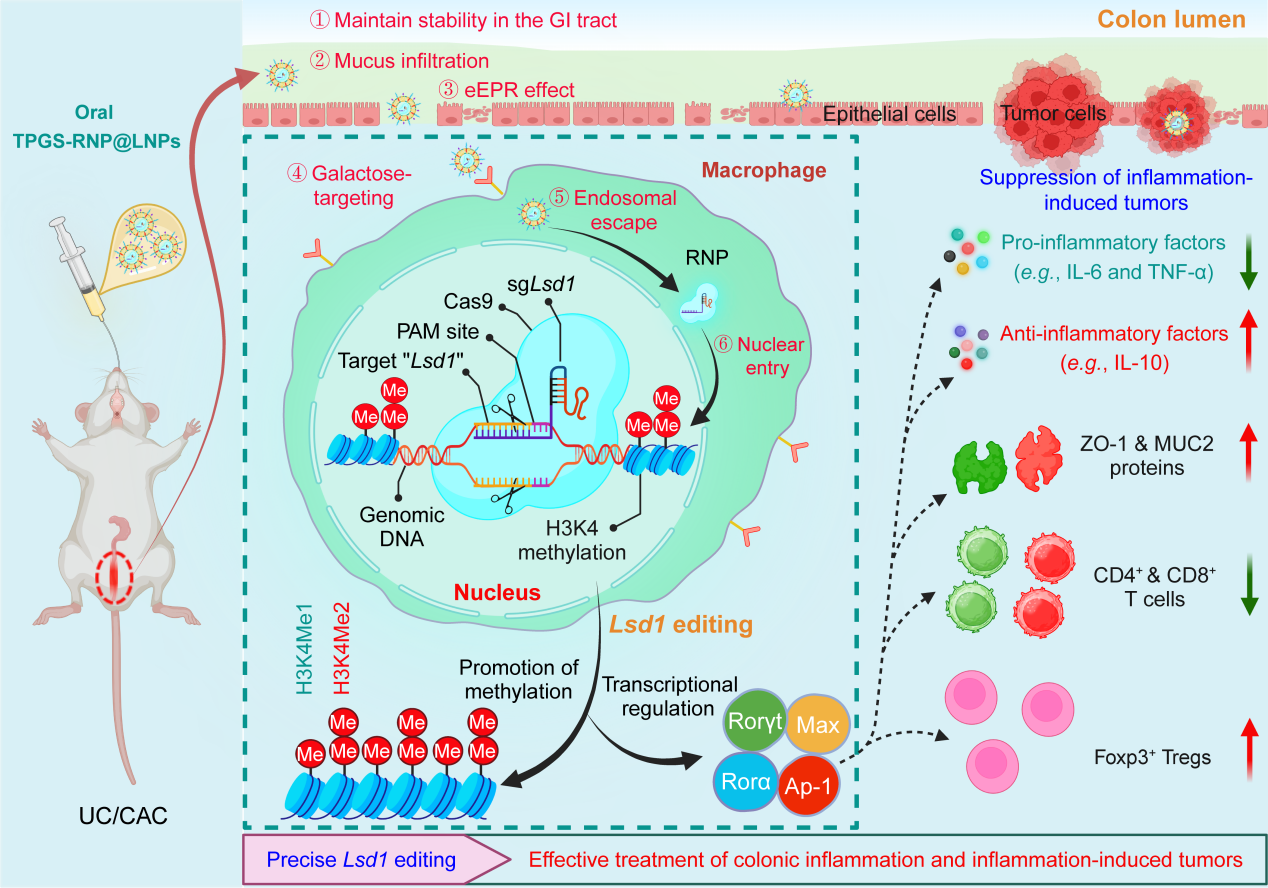
溃疡性结肠炎(UC)是一种慢性炎症性结肠疾病,并显著增加结肠炎相关结直肠癌(CAC)的患病风险。当前其临床治疗主要依赖于抗炎药和免疫抑制剂,仅能缓解症状且副作用大,缺乏针对病因的靶向疗法。CRISPR-Cas9基因组编辑技术为炎症性疾病、遗传病及癌症提供了精准治疗的新途径,具有编辑效率高、免疫原性低和脱靶率低,被认为是最具应用潜力的基因编辑方式。然而,基因编辑系统在体内易于降解、细胞摄取率低,亟需安全、高效的递送系统。
近年来,脂质纳米颗粒(LNPs)已成为核酸药物递送的重要工具,可促进Cas9/sgRNA核糖核蛋白(RNP)跨膜进入细胞并实现多组织的精准编辑,但现有基于LNP的RNP递送系统几乎均依赖静脉注射,存在依从性差、感染风险高及全身分布等问题。相比之下,口服递送具有非侵入性、低成本及局部作用等优势,更契合结肠疾病的治疗需求。然而,传统LNPs在胃酸、消化酶及肠道菌群作用下极不稳定,且难以穿透结肠黏液屏障。值得注意的是,近年来肖波教授团队研究发现植物源性LNPs具有天然的胃肠道稳定性,能高效封装并口服递送多种类型的药物。
鉴于此,肖波教授团队进一步开发了一种基于植物源性结构加固型LNPs的口服递送平台:将靶向 Lsd1的RNP封装进桑叶来源的脂质纳米颗粒,并加入FDA批准的稳定剂d-α-生育酚聚乙二醇琥珀酸酯(TPGS)。TPGS的引入显著增强了LNP的脂质双分子层稳定性,使其能够在恶劣胃肠环境中高效递送RNP,并提高了其穿透结肠黏液屏障的能力。进一步地,TPGS-RNP@LNPs通过上皮细胞增强通透与滞留效应(eEPR效应)在炎症结肠组织中富集,并通过半乳糖受体实现对巨噬细胞的特异性靶向。同时,纳米颗粒与内体膜的膜融合机制结合Cas9的核定位信号,确保了RNP的高效核递送。最终,该系统在小鼠中实现了高效Lsd1基因编辑效果,并有效缓解了UC和CAC。TPGS-RNP@LNPs作为一种基于植物源性LNP的口服RNP递送系统,为结肠疾病的精准治疗提供了一个有前景的口服药物递送平台。
肖波教授一直围绕口服药物系统的应用基础与临床转化开展研究工作,先后以通讯作者身份在《Gastroenterology》《Science Advances》《Nature Communications》等国际权威期刊上发表学术论文90余篇。
论文链接:https://www.science.org/doi/10.1126/sciadv.adw9275
编辑:刘瑶 / 审核:王晓刚 / 发布:陈伟


